Les ions et l'éléctronégativité
Un ion monoatomique ( composé d'un atome) est un atome chargé par la perte ou le gain d’un électron.
Si un atome, par exemple, l’aluminium qui a 3 e- sur sa dernière couche. Si celui-ci perd 3 e-, il deviendra positif car sa charge était neutre au départ mais il devient positif suite à la perte des 3 l'éléctrons.
Mais pourquoi devient t'il positif ?
Car un électron est toujours négatif. Donc, si on enlève des électrons de l’atome,il y aura plus de protons positifs que d’électrons négatifs. Dès lors, il devient positif. On appelle cet ion un cation.
Au contraire, si un atome, par exemple le fluor, se voit ajouter un e-, cet atome devient négatif car on a rajouté un e-(donc une charge négative) a un atome neutre. On appelle cet ion un anion.
Mais comment savoir si un atome perd ou gagne des électrons ?
On peut le savoir grâce au Modèle de Bohr. Ce modèle permet de schématiser les électrons sur la dernière couche d’un atome
Petite astuce : les métaux seront toujours des cations et les non-métaux toujours des anions.
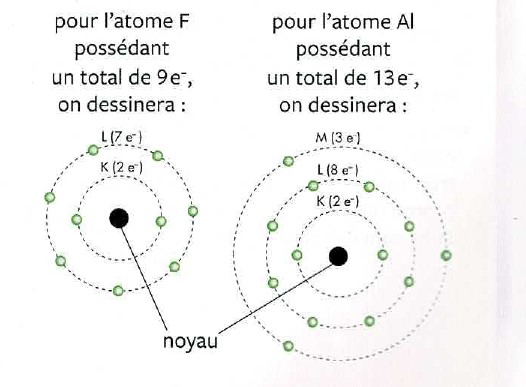
Ex : Na (le sodium) a 3 couches car il est dans la 3ème ligne du tableau (période 3). Et il a 11 électrons car son nombre atomique est de 11.
Attention : les couches des électrons ont une certaine limite de contenance : la couche K peut avoir 2 e- , la couche L ne peut en avoir que 8 et la couche M peut en avoir maximum 18. Vu que Na n’a qu’un seul e- sur sa dernière couche, Na va le perdre et devenir Na+.
Pour trouver les ions plus facilement sans le modèle de Bohr il suffit d’utiliser les familles des atomes. Celles-ci désignent le nombre d’e- qu’il y a sur la dernière couche, ce qui permet de savoir si l’atome perd ou gagne des e-.Mais petite astuce,les métaux perdent des électrons et les non-métaux en gagnent.
Ia : perd 1 e-= x+
IIa : perd 2 e- = x+2
IIIa : perd 3 e-= x+3
IV : gagne 4 e-= x-4
V: gagne 3 e- = x-3
VI : gagne 2 e- = x-2
VII : gagne 1 e- = x-
VIII : x (couche déjà remplie et donc pas d’ions)
L’électronégativité
L’électronégativité ( χ ) est la tendance de l’atome a attirer des électrons. Plus celle-ci est grande plus elle attire des électrons. Cette information est sur la carte d’identité de l’atome.
Récapitulatif vocabulaire
Ion : atome chargé positivement ou négativement par des électrons.
Anion : ion négatif par le gain d'un ou plusieurs éléctrons.
Cation : ion positif par la perte d'un ou plusieurs éléctrons..
Électronégativité : tendance de l’atome à attraper des électrons.